重症监护技术的进步显著提升了重度脑损伤患者的存活率,同时也提高了意识障碍(disorders of consciousness,DoC)的发生率,包括植物状态/无反应性觉醒综合征(vegetative state,VS/unresponsive wakefulness syndrome,UWS)和微意识状态(minimally conscious state,MCS)。目前,仅有金刚烷胺在亚急性期重度脑损伤合并DoC患者的促醒治疗中提供了II类证据,尚无其他明确有效的促醒治疗方法。2025年7月,空军军医大学西京医院神经内科江文教授团队在Neurotherapeutics(2025 IF=6.9)发表了文章:Effect of cerebellar stimulation on awareness recovery in disorders of consciousness (CARE-DoC): A randomized, sham-controlled, crossover clinical trial,为DoC患者昏迷促醒这一难题提供了新的治疗思路[1]。一、背景介绍经颅磁刺激(transcranial magnetic stimulation,TMS)是一种调节神经兴奋性的非侵入性神经调控技术,在DoC治疗中显示出重大潜力。既往TMS在DoC中的随机对照试验多采用高频重复性TMS靶向运动皮层或背外侧前额叶皮层(dorsolateral prefrontal cortex,DLPFC),但结果存在不一致性。这种差异可能源于研究设计、刺激参数以及刺激脑区选择上的不同。因此,优化刺激模式并确定更有效的刺激靶点,对于改善治疗效果至关重要。丘脑-皮层环路的完整性对于意识恢复至关重要。传统上认为小脑(cerebellum)主要参与运动控制,也在情绪和认知等更高级的脑功能中发挥着重要作用。小脑与丘脑之间存在兴奋性连接,丘脑再投射至包括额叶和顶叶在内的皮层区域,这一小脑-丘脑-皮层环路为促进意识恢复提供了潜在路径。初步研究发现,对MCS患者进行小脑经颅直流电刺激(transcranial direct current stimulation,tDCS)可以增加额叶和顶叶皮层的θ波和γ波功率,并与短暂的意识改善相关。动物研究也表明,激活小脑浦肯野细胞可以增强皮层活动,有助于从麻醉中恢复意识。基于上述发现,本研究采用了一种强效的兴奋性TMS方案——间歇性θ节律爆发刺激(intermittent theta burst stimulation,iTBS),并通过神经导航定位于小脑第VII小叶。该区域与额顶叶网络密切连接,而额顶叶网络被认为与意识密切相关,因此对该区域的刺激可能有助于强效调控额顶叶网络活动。本研究旨在评估小脑iTBS(CRB-iTBS)治疗意识障碍的有效性与安全性,以期为这一临床难题提供新的治疗思路。二、实验流程本研究为随机、双盲、交叉、伪刺激对照临床试验。基线评估(Baseline assessment)患者接受为期5天的基线评估,包括人口学资料、临床特征、MRI影像、CRS-R量表评估等。治疗干预(Treatment)1、TMS干预(1)阈值检测在第一次治疗前检测双侧大脑半球的静息运动阈值(resting motor threshold,RMT)。仅一侧可测者按该侧RMT设定双侧刺激强度;双侧均不可测者则取50%最大输出强度作为RMT。(2) 靶点定位将受试者的结构性MRI数据导入神经导航系统(Quicks Vision,深圳英智),并依据MRI解剖图谱定位线圈靶向小脑第VII小叶[2](图1B)。(3)刺激参数真刺激:刺激过程中,借助导航系统实时监控并保持线圈的位置与方向。使用TMS设备(M-100 Ultimate,深圳英智)搭配双锥线圈进行刺激。刺激强度为小脑对侧初级运动皮层90%RMT,并根据个体头皮-皮层距离进行校正[3]。iTBS 模式为每簇3个50Hz脉冲,以5 Hz重复;每串TBS持续2秒,间歇8秒,每10秒重复一次,总时长 200 秒(共 600 脉冲,图1C)。伪刺激:将线圈相对于靶点旋转 90 度,其它参数与真刺激保持一致。※ 每次刺激对左右小脑半球进行顺序刺激,2侧刺激间隔5分钟,连续5天。※ 每次治疗前后2小时内进行CRS-R量表评估。※ 所有受试者在刺激期间均佩戴耳塞,以屏蔽听觉干扰。2、采集脑电及数据分析在第一次治疗前后和第五次治疗后30分钟内采集20分钟静息态脑电数据。记录过程中,患者保持清醒、睁眼,如出现闭眼情况,则执行觉醒促进方案[4]。基于不同频段的功率谱密度(power spectral density,PSD)对EEG信号进行“ABCD”模式分析,以解码丘脑-皮层环路的完整性及意识的保留情况(图2)。
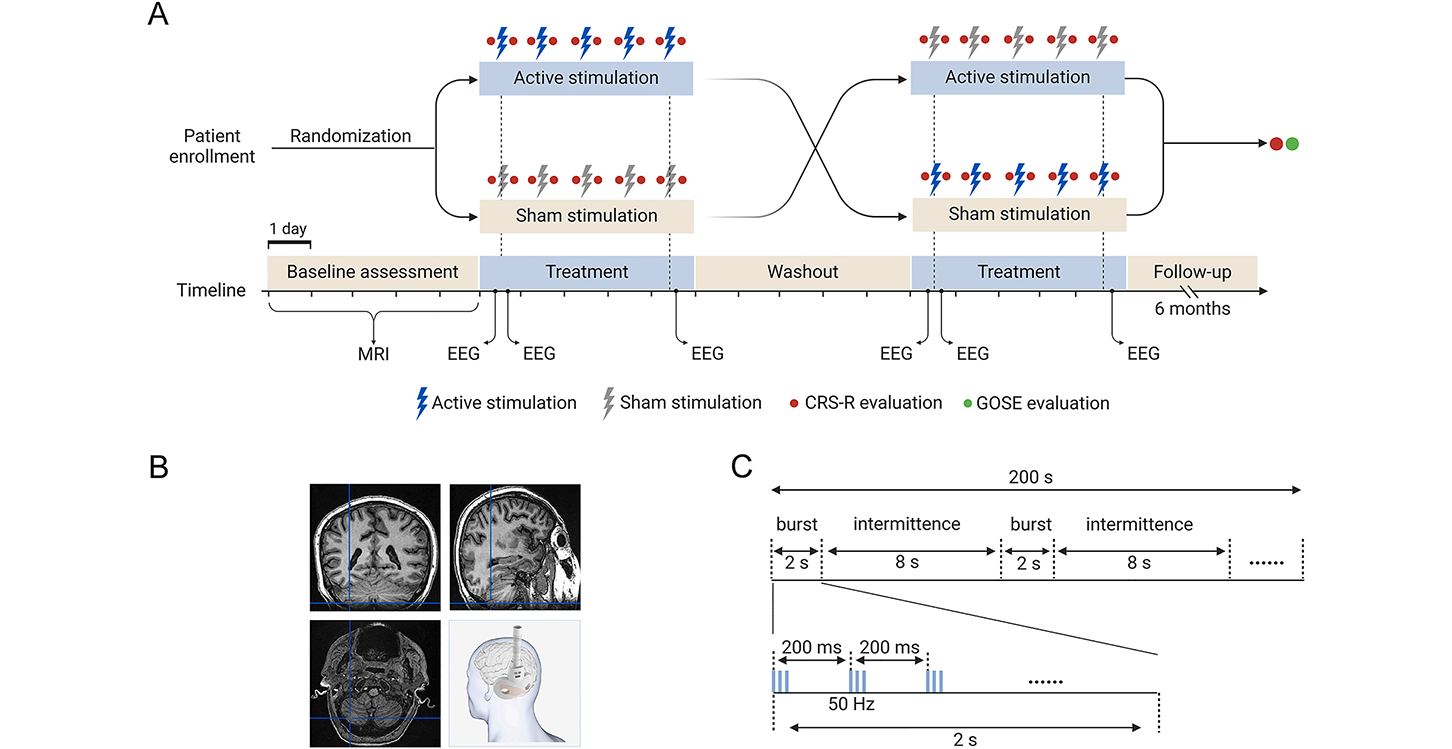
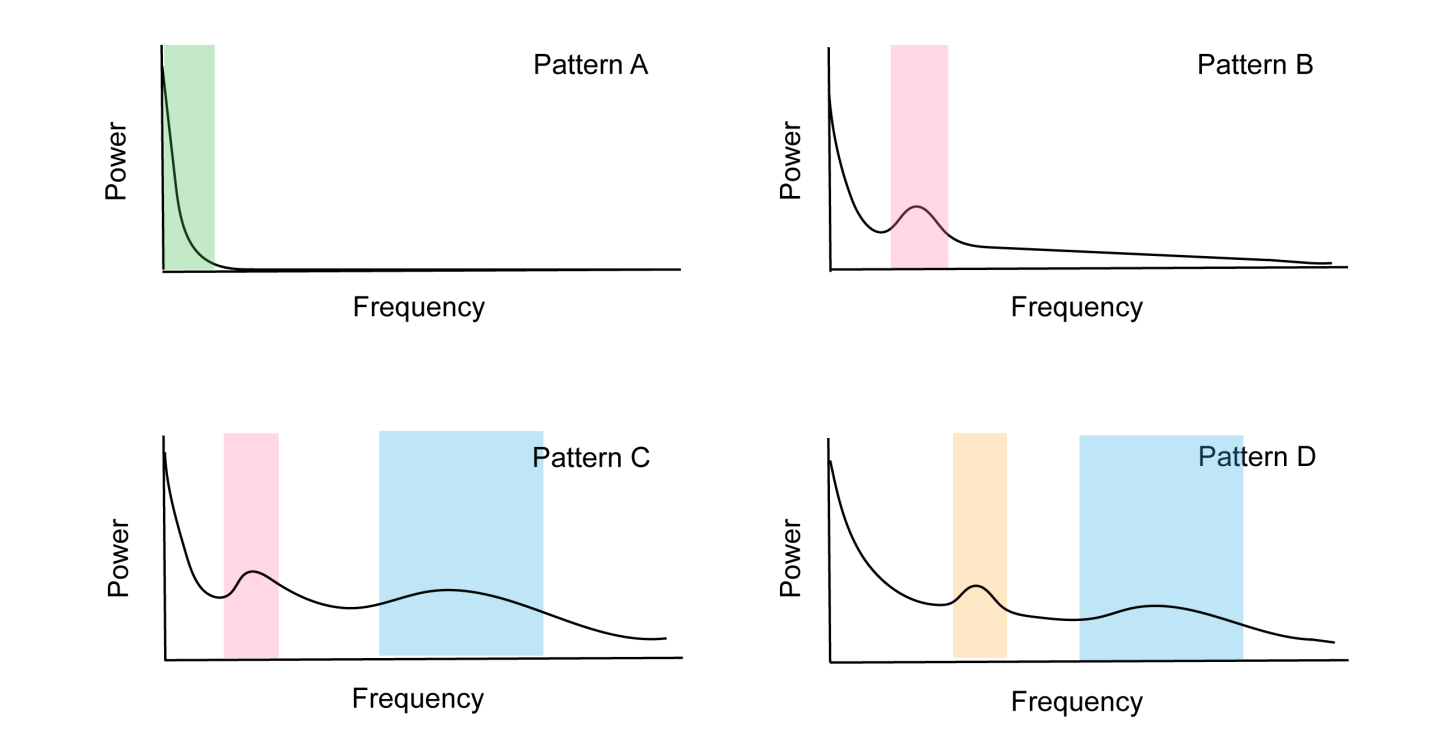
图2:“ABCD”EEG模型
模式A:丘脑-皮层环路完全丧失,EEG功率谱<4 Hz;
模式B:第V层锥体细胞在θ频段(4–7 Hz)进行狭窄振荡,源于新皮质神经元去极化伴膜电位抑制;
模式C:θ和β频段振荡并存,源于新皮质膜电位部分恢复与去传入丘脑神经元同步爆发;
模式D:α和β频段的正常新皮层神经元放电模式。
3、基础治疗与常规康复从基线评估开始至最后一次EEG和行为评估完成期间,停用所有镇静药物及可能干扰脑刺激的药物(如Na⁺/Ca²⁺通道阻滞剂或N-甲基-D-天冬氨酸受体拮抗剂),以避免对EEG和意识评估产生干扰。其他药物治疗、物理治疗及康复干预在整个试验过程中保持不变。5天洗脱期(Washout)真伪刺激交叉干预(Treatment)3个月、6个月随访(Follow-up)
图1:研究设计
(A) 试验流程时间线:基线评估期完成临床评估及磁共振成像;随后患者随机接受CRB‑iTBS或伪刺激。5天洗脱期后,交叉至另一种干预。每个干预期包括连续5天的每日刺激(CRB‑iTBS 或伪刺激)。首次治疗前后和第五次治疗后30分钟内进行EEG记录;在每次治疗前后2小时内评估CRS‑R。
(B) 在神经导航引导下,采用双锥线圈对小脑实施CRB‑iTBS。
(C) iTBS刺激模式示意图:每列包含3个50Hz脉冲,以5Hz重复,每列持续2秒,每10秒重复一次。
三、研究结局1、主要结局真伪刺激组在五次治疗后CRS-R总分变化的组间差异。
2、预先设定的次要结局
真伪刺激组在五次治疗后CRS-R各子量表分数变化的组间差异;
五次治疗后“ABCD”EEG模式比例在真伪刺激组间的差异。
3、事后分析的次要结局
首次治疗后CRS-R总分及子量表分数变化的组间差异;
首次治疗后“ABCD”EEG模式比例在真伪刺激组间的差异。
4、功能结局及意识恢复
在治疗后三个月及六个月,随访人员对患者本人或其看护者进行结构化电话随访,以评估功能结局及意识恢复情况。
功能结局采用改良格拉斯哥预后量表(GOSE)评分,GOSE≥4 视为良好预后,GOSE<4 视为不良预后。
若患者意识水平改善,从UWS→MCS/EMCS,MCS-→MCS+/EMCS,MCS+→EMCS,即归为“意识改善组”;若意识水平未变或下降,则归为“无改善组”。对于随访期内死亡的患者,则以上次可评估的意识状态为准。
四、结果分析
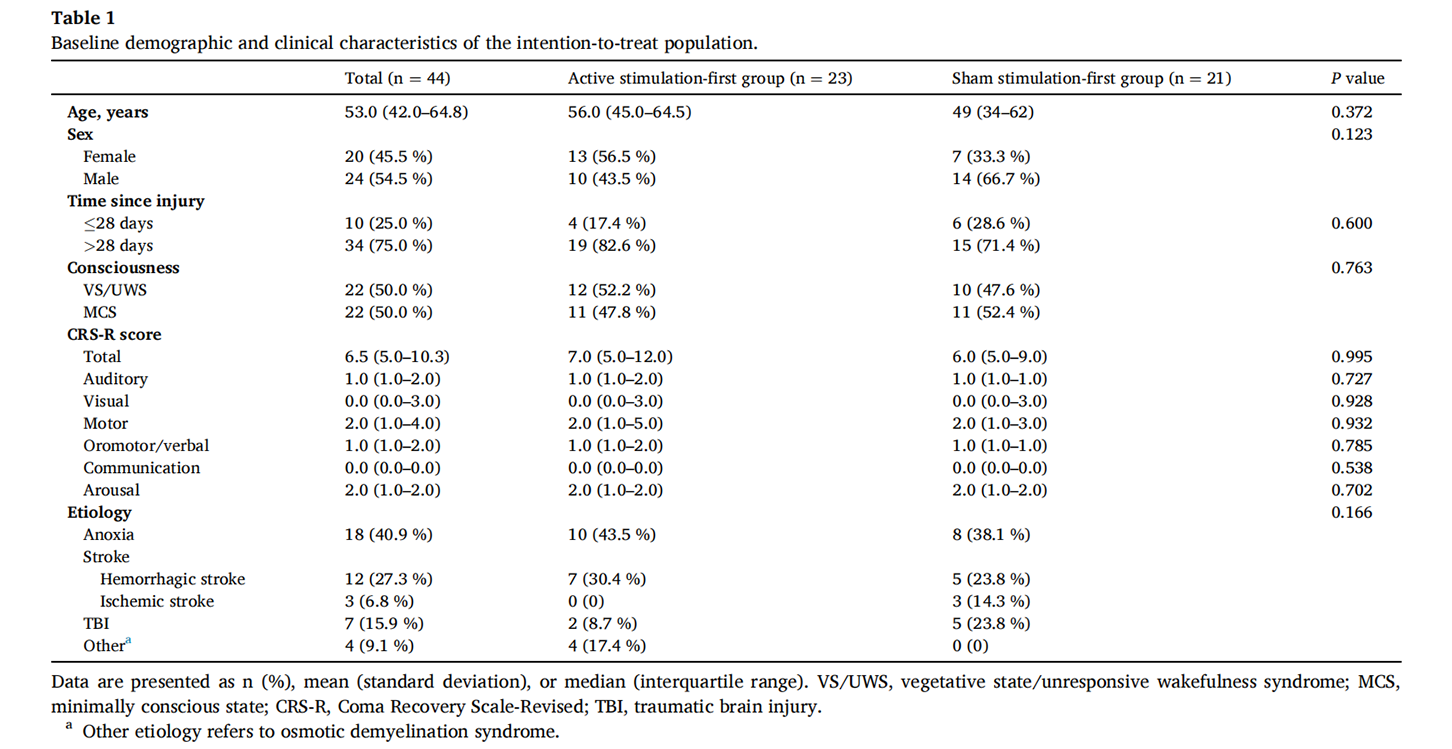
1、基线人口学及临床特征
自2022年4月29日至2024年3月2日,共筛查101例DoC患者,其中44例接受随机分组。23例分配至先真刺激组,21例分配至先伪刺激组,均纳入意向性治疗(intention-to-treat,ITT)分析集(表1)。
其中6例患者被排除:4例撤回同意,2例在真刺激期间出现不耐受表现,纳入符合方案(per-protocol,PP)分析集中,先真刺激组和先伪刺激分别有20例和18例。
表1:ITT分析集基线人口学及临床特征
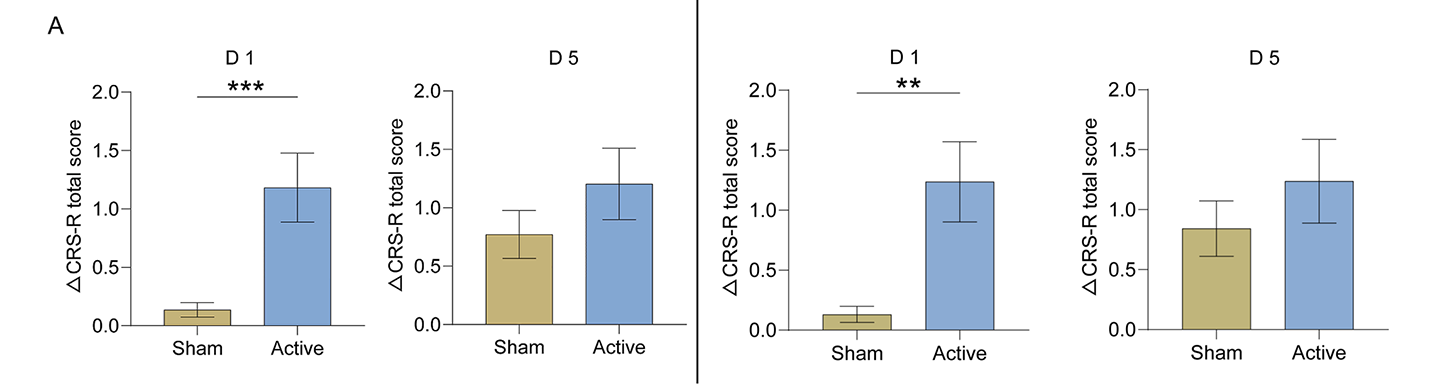
2、CRB-iTBS对意识和EEG的影响在ITT分析集中,真伪刺激组在五次治疗后的CRS-R总分变化无显著差异(见图3A),PP分析集结果相同(图S2)。然而,在首次治疗后,真刺激组CRS-R总分提升显著高于伪刺激组,尤其在听觉、视觉、口部运动/语言及觉醒子量表中更为明显。
左:图3A ITT分析集 右:图S2 PP分析集
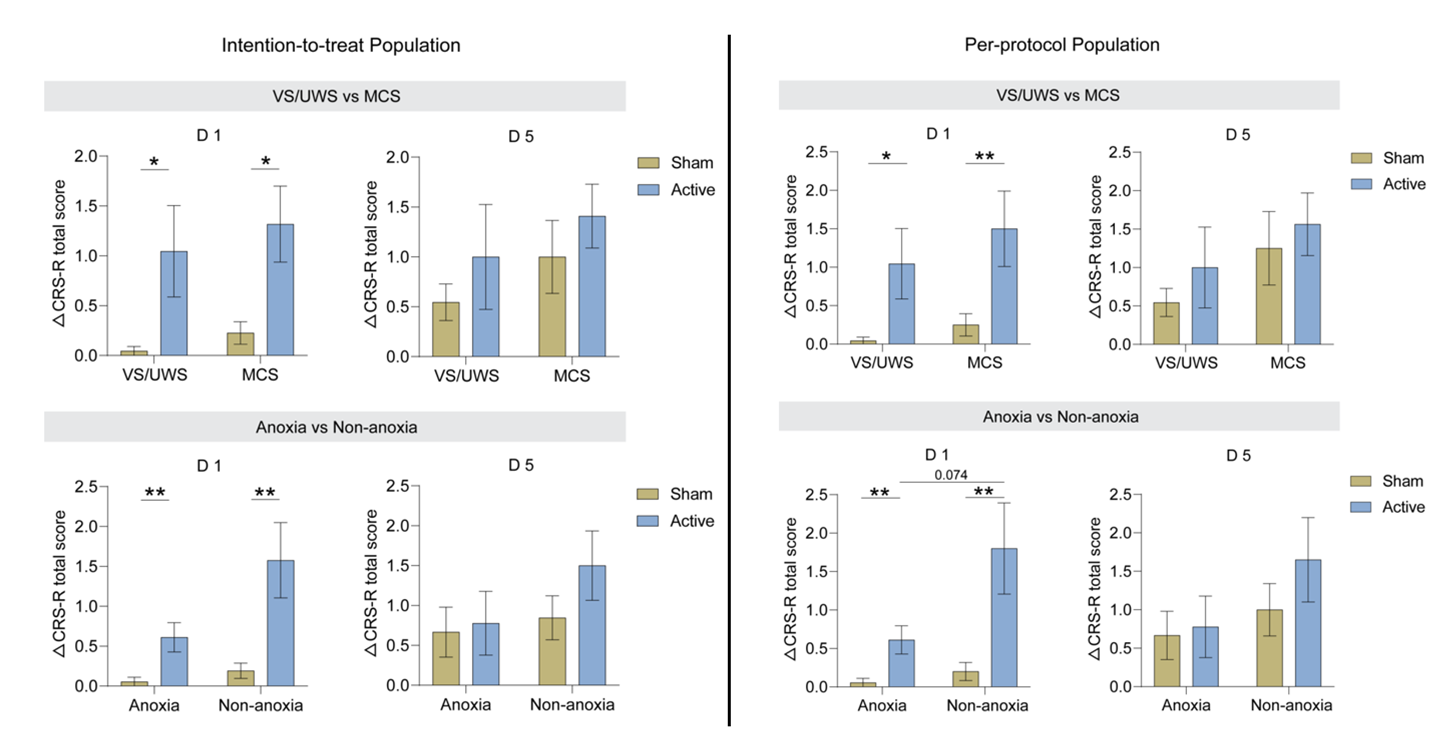
亚组分析显示,首次治疗后,无论意识状态(VS/UWS或MCS)或病因(缺氧或非缺氧),真刺激均能显著改善CRS-R总分,但在五次治疗后无此效应(图S3、S4)。有趣的是,非缺氧患者在首次治疗后的CRS-R总分改善较缺氧患者更为明显(图S4)。
左:图S3 ITT分析集 右:图S4 PP分析集
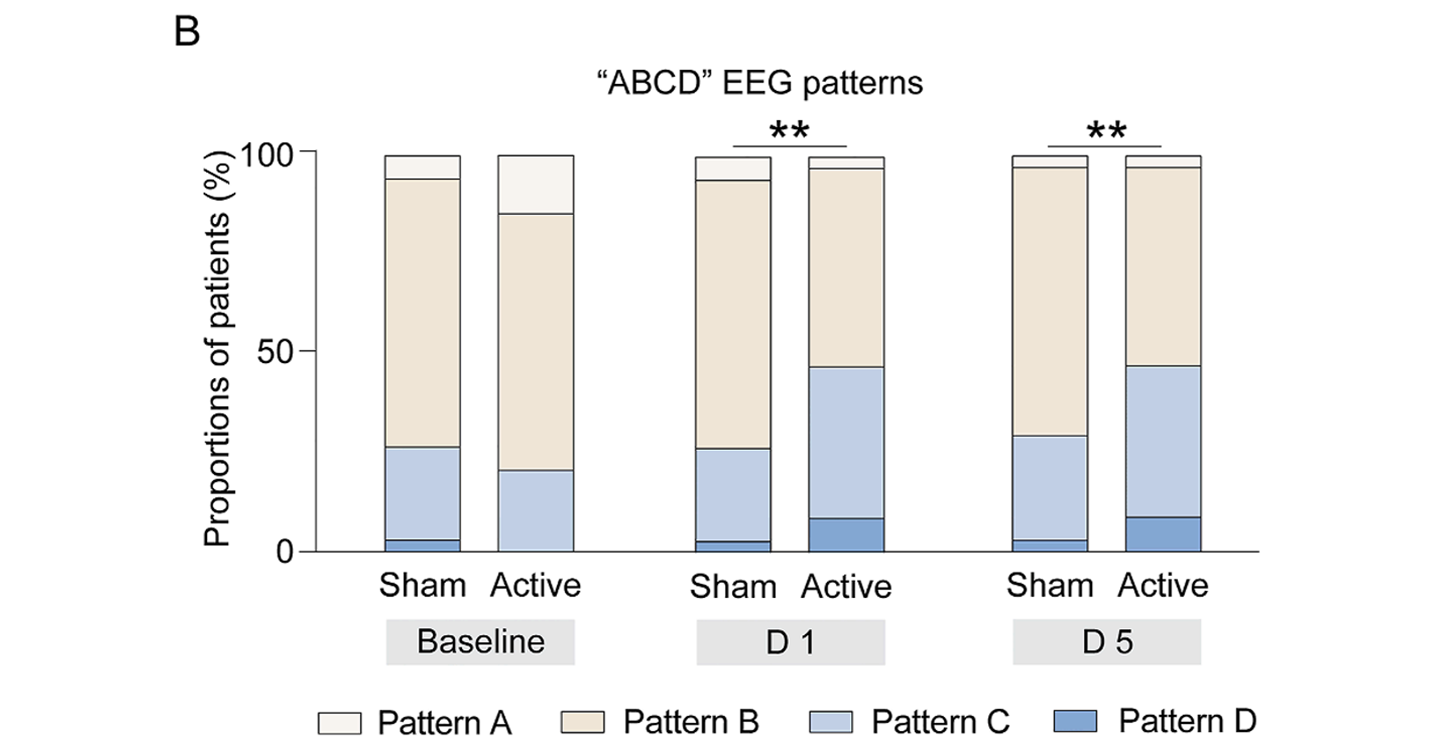
基线“ABCD”脑电模式在两组间分布相似。真刺激组首次和第五次治疗后“ABCD”脑电模式分布均显著改善,更多患者呈现模式C和D(图3B)。此外,首次治疗后真刺激组在额叶、顶叶和枕叶的δ频段全脑PSD显著降低,但五次治疗后未见该效应。
图3B
3、长期结局与安全性
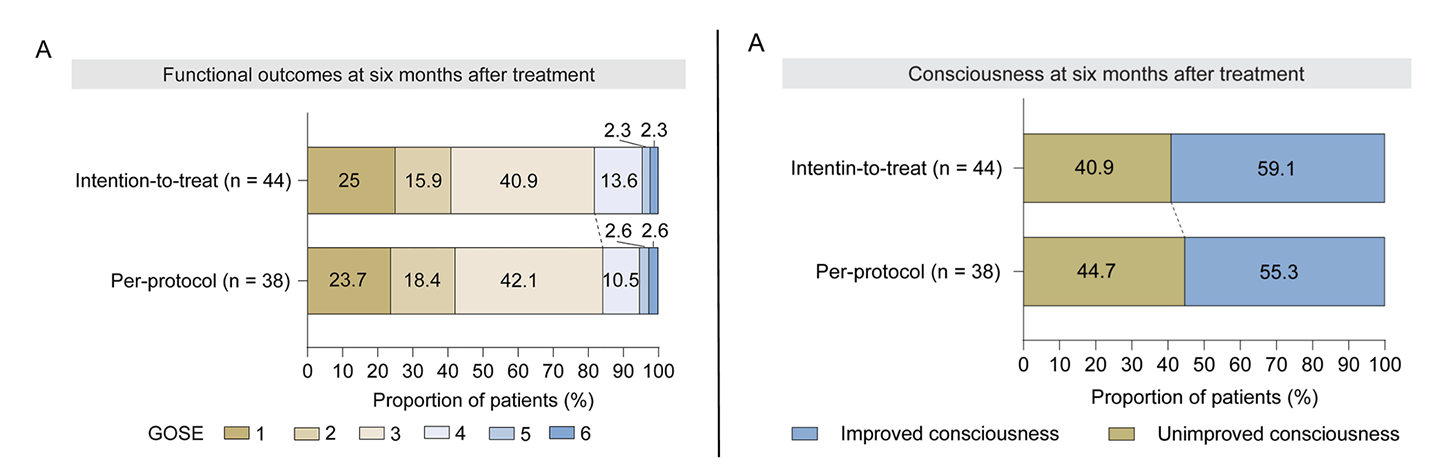
ITT分析集中,治疗后三个月时,9.1%(4例)患者达到良好预后,50%(22例)患者意识水平改善;治疗后六个月时,这一比例分别升至18.2%(8例)和59.1%(26例)(图4A,图S7A)。
左:图4A 右:图S7A
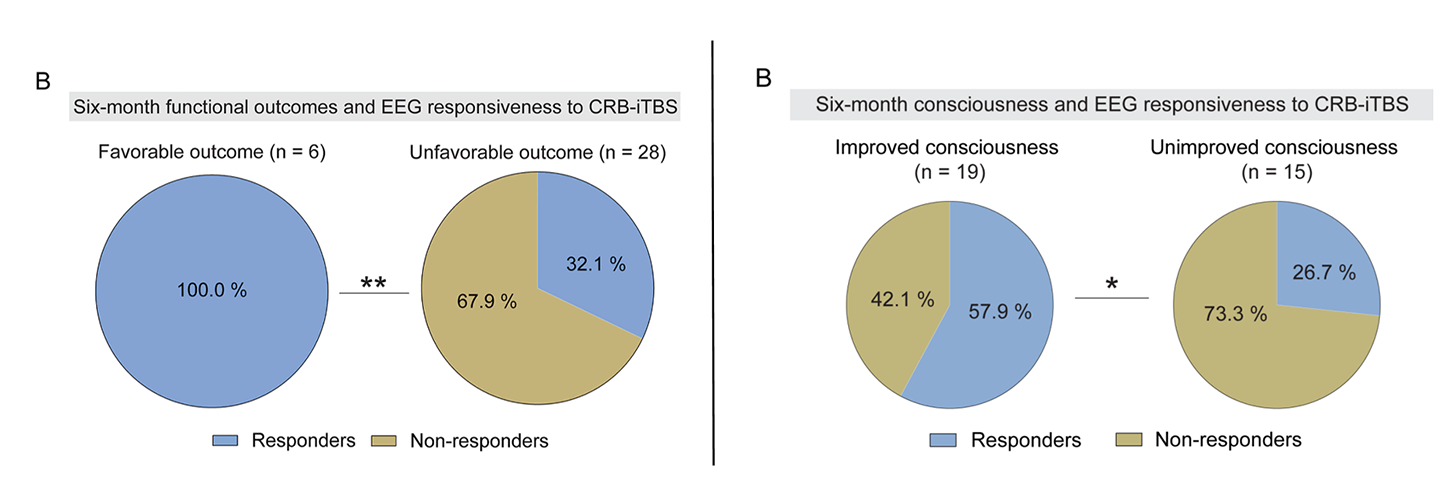
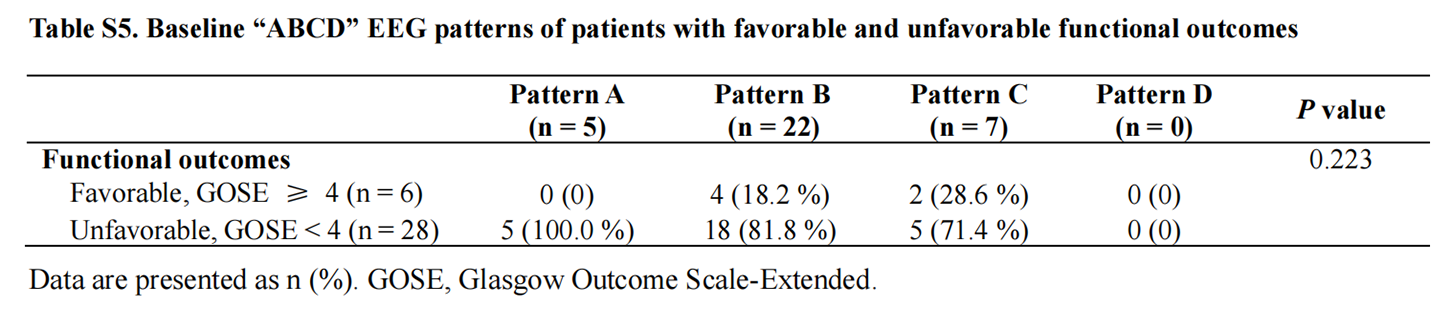
基线“ABCD”脑电模式与六个月功能结局无显著相关性(表S5),但与意识恢复显著相关(表S6)。在治疗期间出现“ABCD”脑电模式提升的“反应者”更易获得良好预后:在良好预后患者中,100%为脑电模式反应者,而在不良预后组中仅32.1%(图4B);同样,脑电模式反应者在意识改善组中显著多于未改善组(图S7B)。
左:图4B 右:图S7B
表S5
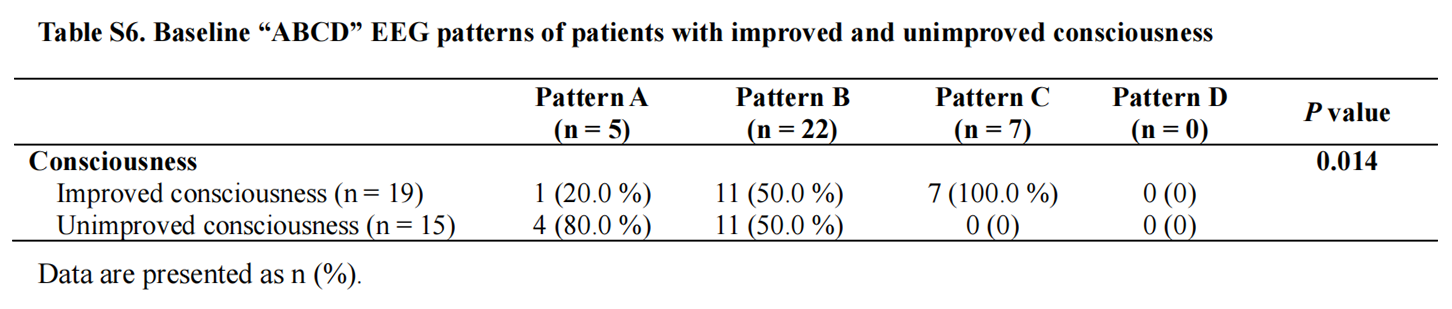
表S6
安全性方面,2例患者在真刺激过程中出现面部疼痛表情、呻吟、哭泣及头部运动等不耐受表现;随访期间11例患者死亡,整个研究期间未出现其他不良或严重不良事件。
五、讨论
本研究发现,五次真刺激后对意识恢复的效应未能持续,但CRB-iTBS 在首次刺激后能短暂改善 DoC 患者的意识,“ABCD”脑电模式增强,提示丘脑-皮层环路完整性增强。对治疗有反应的患者,长期随访显示更好的功能及意识恢复。
CRB-iTBS诱发的短暂但显著的意识改善,与先前研究中的神经调控效应相呼应。导致该暂时性疗效的因素可能包括:
首先,基线特征本身具有挑战性——一半患者处于VS/UWS状态,且许多患者病因为缺氧(通常预后更差且神经损伤更广泛)。非缺氧患者在首次刺激后的CRS-R改善更为显著,也反映了缺氧性DoC治疗的难度。然而,纳入病因多样的患者更能反映真实临床情境,强调了为所有DoC患者开发有效疗法的必要性。
其次,五次连续刺激后效应的减弱可能与对CRB-iTBS的快速神经适应性反应有关。
第三,DoC患者的意识水平本身具有自发波动性,5天内CRS-R总分的自发波动或削弱了真伪刺激间的差异。
EEG结果表明,CRB-iTBS能够增强丘脑-皮层环路的完整性。首次刺激后,额叶、顶叶和枕叶的δ频段PSD下降。δ振荡与皮层神经元的超极化有关,常见于睡眠、麻醉及DoC状态,其功率降低表明神经元兴奋性的恢复。此外,CRB-iTBS后“ABCD”脑电模式C型和D型增加,提示丘脑-皮层连接性的改善。虽然“ABCD”脑电模式的变化在第五次刺激后依然存在,但行为学评估仅在首次刺激后出现改善,其潜在机制有待进一步探究。
6个月随访显示,18.2%的患者获得良好预后,59.1%意识水平改善,这一比例超过了先前对DoC实施丘脑深部脑刺激的报道。对 CRB‑iTBS 有反应的患者更可能获得良好的长期功能及意识结局,提示他们可能具备更完整的神经结构,有助于丘脑-皮层环路恢复。早期识别“反应者”有助于优化CRB-iTBS的临床应用,最大化患者获益。
与以往“自上而下”策略(靶向DLPFC或运动皮层)不同,本研究突出了小脑作为一种“自下而上”意识恢复靶点的可行性。小脑对丘脑具有兴奋性投射,进而调节广泛的皮层区域,为影响皮层功能提供了独特通路。本研究选取与额顶叶网络密切关联的小脑第VII小叶进行iTBS刺激,该网络对意识至关重要。首次刺激后CRS-R听、视、口部运动/语言及觉醒子量表均出现暂时性改善,表明刺激可能通过小脑的多种投射来调节广泛的皮质及皮下结构。
六、结论
CRB‑iTBS在连续五次每日治疗后未能持续促进意识恢复,但首次刺激后短暂提升了意识水平并增强了丘脑-皮层环路的完整性。未来需通过优化刺激方案的研究,进一步探索小脑作为“自下而上”刺激靶点在DoC治疗中的潜力。