缺血性脑损伤会引发一系列复杂的基因表达、分子信号、细胞机制及电生理活动,这些过程促进大脑皮层的功能重塑与突触再生,构成卒中后自发恢复的神经生物学基础。研究表明,卒中后两周内实施康复策略与更有利的预后相关。
近日,首都医科大学附属北京天坛医院的李子孝教授团队,通过TMS-EEG技术,深入揭示了急性缺血性卒中后两侧大脑半球间的动态作用,发现健侧初级运动皮层(primary motor cortex, M1)对患侧M1的β频段神经振荡具有抑制作用,而这种抑制与运动功能障碍程度及后续恢复密切相关。
该发现进一步印证了“半球间竞争”模型在卒中恢复早期阶段的作用机制,提示调控β振荡可能成为新型神经调控干预的重要方向。

一、研究方法
1.研究对象
单中心病例对照研究(2022年12月至2024年5月,首都医科大学附属北京天坛医院神经内科)
19例症状出现14天内确诊的缺血性卒中患者
(平均年龄为47.95±12.41岁;15例为男性)
16名年龄和性别匹配的健康对照者
(平均年龄为53.56±9.83岁;12名为男性)
纳入标准
(1) 年龄在18至80岁之间
(2) 经扩散加权磁共振成像证实为单侧缺血性脑卒中
(3) 卒中发作时间在14天以内
(4) 存在单侧上肢运动功能障碍
排除标准
脑卒中患者:存在TMS或MRI禁忌症、双侧脑梗死、脑出血、认知障碍或因失语而无法签署知情同意书的患者。
健康对照组(healthy control, HCs):存在神经系统或精神疾病病史、运动障碍,或存在TMS或MRI的禁忌症。
2.研究设计
(1)功能评估
入组后48小时内,评估卒中后基线功能状态:
评估初始功能障碍程度
美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale, NIHSS)
轻度卒中定义为基线NIHSS ≤ 5
重度至中重度卒中定义为基线NIHSS ≥ 6.25
Fugl-Meyer运动功能评估(Fugl-Meyer assessment, FMA)
FMA上肢亚量表(FMA-upper extremity)评估初始功能障碍程度
评估患者日常生活活动能力
改良Rankin量表(modified Rankin Scale, mRS)和Barthel指数
评估瘫痪侧上肢的肌张力
改良Ashworth量表
卒中3个月时重新评估NIHSS(NIHSS3m)和mRS(mRS3m)
NIHSS评分的变化(ΔNIHSSbaseline-3m)用于评估卒中后的恢复情况
(2)TMS-EEG
本研究采用8字形线圈(M-100 Ultimate;深圳英智科技有限公司,深圳,中国)进行聚焦磁刺激。
在TMS-EEG同步记录过程中,使用实时神经导航系统(ROB 9000系列;深圳英智科技有限公司)结合每位受试者的T1加权磁共振成像扫描,对M1区域进行精准定位刺激。
头皮脑电图采用兼容TMS的Ag/AgCl烧结C环电极,通过弹性电极帽(EasyCap GmbH,德国)按照国际标准10-20电极系统放置,并连接TMS兼容的64通道脑电系统(actiCHamp Plus C;深圳英智科技有限公司)进行采集。

①运动热点的确定
TMS线圈被定位于根据T1加权扫描图像识别的手部运动区(hand knob region)的解剖标志周围。
健侧M1(contralesional M1, clM1)的运动热点定义为:当TMS线圈以45°后-前方向贴近头骨施加单次刺激时,在非瘫手第一背侧骨间肌诱发最大运动诱发电位(MEP)的线圈位置。
患侧M1(ipsilesional M1, ilM1)的运动热点定义为:基于个体T1加权扫描所识别的手部运动区。
②TMS-EEG方案
在脑电图记录期间,对运动热点至少施加80次TMS脉冲,刺激强度为健侧静息运动阈值(resting motor threshold, RMT)的80%,刺激间隔为2.0-4.0 s。
对于卒中患者,单脉冲TMS先刺激健侧M1(clM1),再刺激患侧M1(ilM1)。
对于健康对照组,单脉冲TMS依次施加于优势侧M1和非优势侧M1。
③TMS-EEG实验控制措施
为避免TMS引发的听觉诱发电位以及因TMS点击声导致的眨眼和眼肌反应,要求受试者佩戴耳塞。
为进一步减小TMS引发的骨传导影响,在TMS线圈与脑电电极帽之间置入一层薄塑料膜进行隔离处理。
3.数据分析
对脑电信号预处理后,计算M1区域的局部平均场强(local mean field power, LMFP)和功率谱密度(power spectral density, PSD)。
在健康对照中,M1的LMFP范围为3-7 μV;在卒中患者中,患侧M1的LMFP范围为1.5-3.5 μV,而健侧M1的LMFP范围为4-8 μV。
LMFP在健康受试者和卒中患者之间差异显著,特别是在25-35 ms时间窗内。因此选择25–35 ms区间内的LMFP(LMFP25–35 ms)用于后续分析。
通过Morlet小波变换计算事件相关频谱扰动(event-related spectral perturbation, ERSP)来评估时频域中的频谱特征。重点关注不同感兴趣频段:
δ(<4 Hz)
θ(4–8 Hz)
α(9–12 Hz)
β(13–27 Hz)
低γ(27–50 Hz)
高γ(>50 Hz)
采用Spearman相关分析法评估TMS-EEG指标与卒中后初期的功能损伤及3个月功能恢复之间的相关关系。
二、研究结果
1.基线特征
从开始到完成脑电图检查的平均时间为8.34 ± 2.31天。所有患者均为单侧大脑半球缺血性梗死灶,且上肢肌张力正常(改良Ashworth量表评分为0)。
基线时运动障碍程度从轻度到重度不等,其中5例为轻度卒中,14例为重度卒中,11例患者完全丧失手部运动功能。
基线各项运动功能评估指标如下(数据为中位数 [四分位距]):
FMA总分:35 [19–49]
FMA上肢评分:12 [5–26]
NIHSS评分:7 [5–8]
mRS评分:3 [3–4]
Barthel指数:60 [50–75]
全部患者均完成了3个月随访:
NIHSS3m评分:3 [1–4]
mRS3m评分:1 [1–2]
2.缺血性脑卒中后皮层活动的特征
TEPs TMS诱发电位
在卒中后2周内评估TMS诱发脑电图反应时,发现患侧皮层与健侧皮层在100 ms内的TMS诱发电位(TMS-evoked potentials, TEPs)表现出两种不同特性:
在健康对照中,对M1施加TMS刺激可诱发具有正负偏转的复杂TEPs波形变化。
相比之下,在缺血性脑卒中患者中,当TMS施加于患侧M1时,其TEPs波形更为简单;当TMS施加于健侧M1时,其TEPs的正负偏转幅度较低。
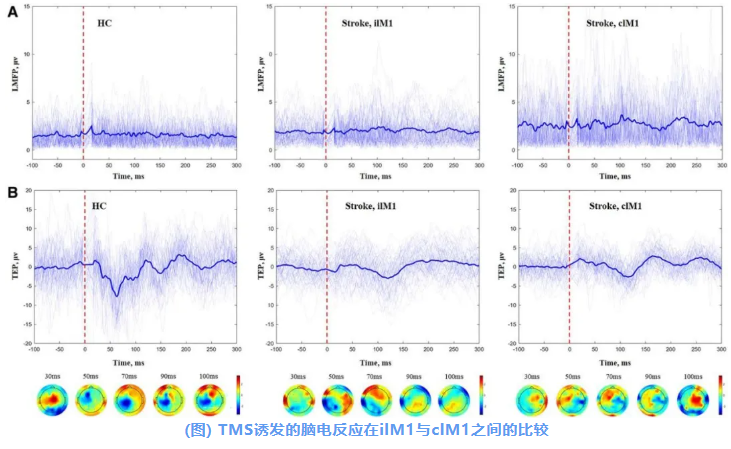
在图中,以蝶形图展示了一名代表性HC与一名卒中患者在患侧M1与健侧M1上的LMFP及TEPs;所有通道的信号均被展示,其中加粗的通道表示感兴趣区域。
研究进一步探讨了在100 ms时间窗内,TMS刺激健侧M1对患侧M1神经活动的影响:
在健康对照中,TMS刺激在对侧M1区诱发了复杂的TEPs波形变化,表现为明显的正负偏转(图A)。
然而,在卒中患者中,对健侧M1施加TMS刺激时,患侧M1的TEPs波形更为简单(图B);当TMS施加于患侧M1时,健侧M1诱发的TEPs仍表现为正负偏转,但振幅较低(图C)。
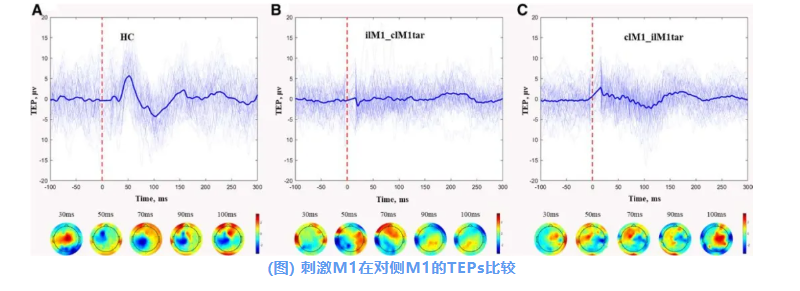
展示了一名代表性HC的M1 TEPs(图A),一名代表性卒中患者在健侧M1刺激下的患侧M1 TEPs(图B),以及一名代表性卒中患者在患侧M1刺激下的健侧M1 TEPs(图C),均以所有通道的蝴蝶图形式呈现(粗体通道代表感兴趣区域)。红色虚线表示TMS脉冲的时点。“ilM1_clM1tar”表示健侧M1刺激下的患侧M1 TEP。
RMT 静息运动阈值
健康对照组的RMT为刺激器最大输出的74.63±9.67%,而卒中患者的健侧RMT为63.42±13.40%,二者差异具有统计学意义(t=−2.79;P=0.009;图A)。
此外,在缺血性卒中患者中,健侧RMT与患侧M1的LMFP25–35 ms呈正相关(r=0.482;P=0.018;图B)。
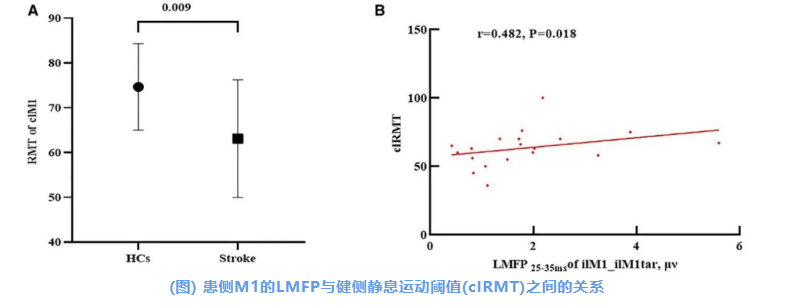
A:两组之间健侧RMT的比较。
B:卒中患者中,TMS刺激后25–35 ms内患侧M1的LMFP与健侧RMT之间的关系。
HC表示健康对照;LMFP25–35 ms表示TMS刺激后25到35 ms内的局部平均场强。
3.患侧M1的TMS诱发振荡频率变化
ERSP 事件相关频谱扰动
PSD 功率谱密度
在健康对照中,100 ms内M1的δ、θ、α、β及低-γ振荡功率显著增加(图A)。轻度卒中患者在100 ms内α、β及γ振荡功率增加(图B);相反,中重度卒中患者在100 ms内β与γ振荡功率减少(图C)。
在分析各频率下的PSD差异时,发现卒中组在37-44 Hz频段存在显著升高(图D)。
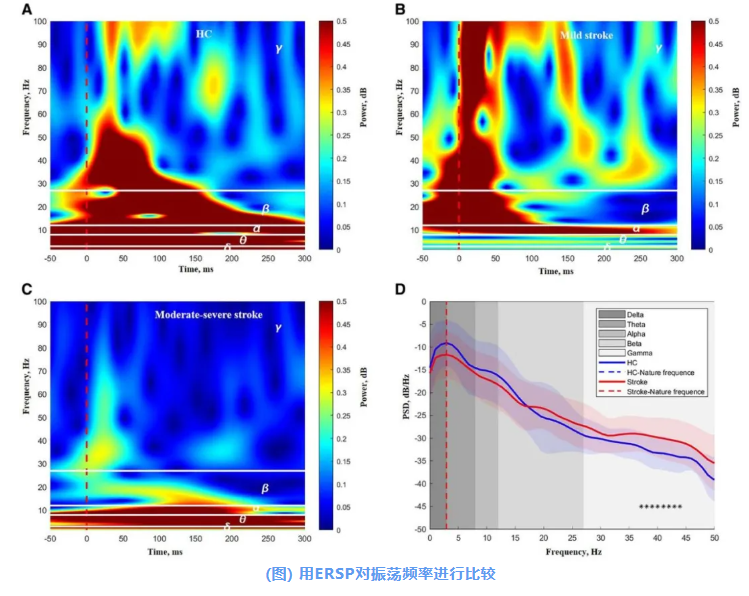
展示了相应的ERSP模式(频率范围在100 HZ以内):1名HC(A)、1名代表性轻度卒中患者(B)和1名代表性中重度卒中患者(C)。两组之间的功率谱密度(PSD)比较见图D。图中红色虚线(A-C)表示TMS脉冲的时点(*:P<0.05,未经多重比较校正)。
Spearman相关分析
研究进一步检验了患侧M1中TMS诱发脑电活动的改变是否与卒中初期的功能损伤有关。β振荡功率与NIHSS评分呈负相关,与Barthel指数评分呈正相关;γ振荡PSD亦与Barthel指数呈正相关。
4.刺激健侧M1对患侧M1的影响
ERSP 事件相关频谱扰动
PSD 功率谱密度
为进一步明确卒中患者中TMS诱发脑电响应的特征,研究提取了在健侧M1 TMS刺激下的患侧M1的振荡频率。
在健康对照中,TMS刺激后100 ms内,对侧M1中δ、θ、α、β及低-γ振荡功率显著增加(图A)。在卒中患者中,TMS刺激后100 ms内患侧M1中的β和低-γ振荡功率显著下降(图B&C)。
与健康组相比,卒中组在健侧M1刺激下患侧M1中16-17 Hz的β振荡PSD显著下降(图D)。
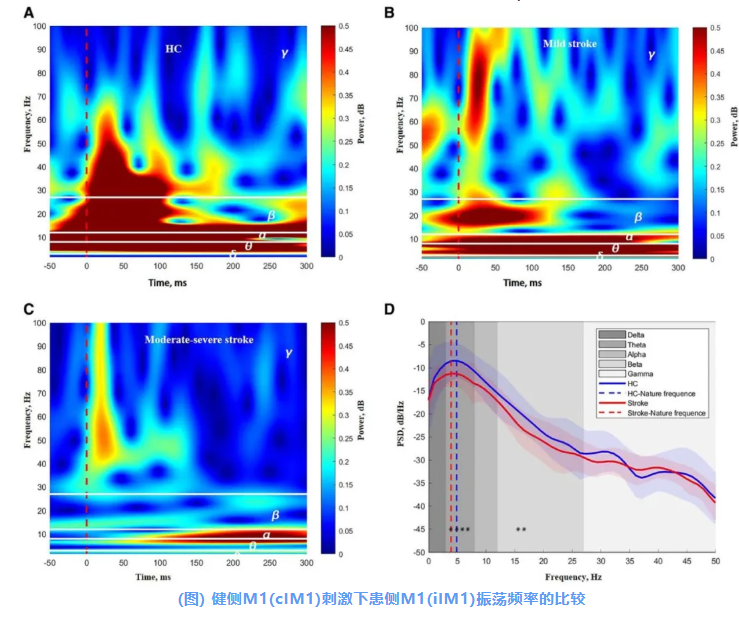
展示了相应的ERSP模式(频率范围在100 HZ以内):1名HC(A)、1名代表性轻度卒中患者(B)和1名代表性中重度卒中患者(C)。两组之间的功率谱密度(PSD)比较见图D。图中红色虚线(A-C)表示TMS脉冲的时点(*:P<0.05,未经多重比较校正)。
Spearman相关分析
研究进一步分析了健侧M1刺激下患侧M1的TMS-EEG指标与卒中后功能障碍和恢复的关系。
β振荡功率与FMA评分(r=−0.557;P=0.014)及FMA上肢评分(r=−0.503;P=0.014)呈负相关(图A&B)。而在刺激健侧M1时,β振荡功率与NIHSS评分变化呈正相关(图C)。
类似地,β振荡PSD与FMA评分呈负相关(r=−0.417;P=0.038;图D),与FMA上肢评分也呈负相关趋势(r=−0.389;P=0.05;图E)。然而,β振荡功率与NIHSS评分变化之间无显著相关性(r=0.271;P=0.131;图F)。
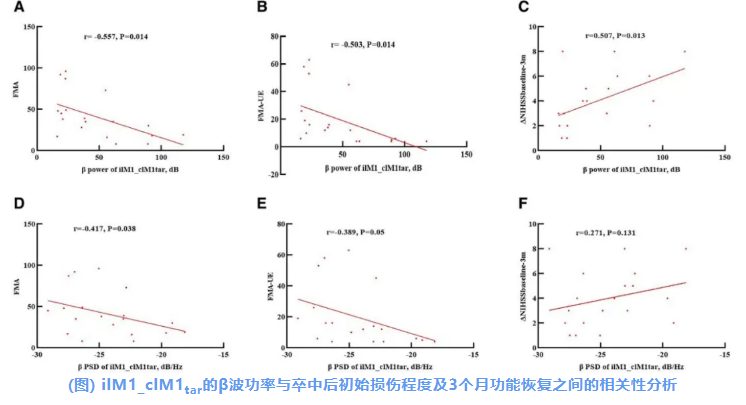
clM1 表示健侧M1;ilM1_clM1tar 表示在刺激健侧M1时患侧M1的TEPs;ilM1 表示患侧M1;PSD 表示功率谱密度。
三、研究讨论与总结
本研究显示,与健康对照组相比,急性缺血性脑卒中患者的患侧M1神经活动显著降低,而健侧M1神经活动则显著增强。在卒中患者中,健侧M1的神经活动增强与患侧M1的神经活动减少呈负相关。
患侧M1中的β和γ振荡活动增强,这一变化与卒中后的初始功能损伤程度呈负相关。而健侧M1则抑制了患侧M1的β振荡活动,该机制与卒中后3个月的功能恢复较差相关。
神经可塑性在缺血性脑卒中的急性期开始显现,并在亚急性期达到高峰,因此这一时期是神经调控干预的关键窗口。本研究中,健侧M1对患侧M1的神经活动具有抑制作用,证实在卒中急性期,“半球间竞争模型”在功能恢复中起主导作用。
本研究中,TEP的早期成分以及β和γ振荡在卒中后均出现异常,提示兴奋性与抑制性神经元之间的动态平衡被破坏。“半球间竞争模型”的潜在机制可能涉及健侧大脑皮层通过影响皮层和皮下谷氨酸能或GABA能神经元的活动,来抑制患侧运动皮层的兴奋性。
高频神经振荡是促进神经元间信息交流和整合的重要机制,尤其是γ振荡活动依赖于GABA受体介导的抑制作用,这表明高频振荡活动主要由抑制性中间神经元网络产生。γ与β振荡在运动控制和认知功能中发挥关键作用,其紊乱可能反映功能损伤及其对神经处理的影响。
卒中后,脑内神经振荡活动受到干扰。在急性缺血性卒中中,患侧M1的γ与β振荡活动增强,并与卒中后的功能障碍严重程度相关。这一关联强调了高频振荡活动作为卒中严重程度与疾病进展生物标志物的潜在价值。
研究总结
健侧M1的兴奋性增强与患侧M1的兴奋性降低密切相关,提示“半球间竞争模型”在急性缺血性卒中后的功能障碍与恢复中发挥主导作用。
健侧M1对患侧M1的β振荡的调控作用,可作为卒中后功能障碍与恢复的生物标志物。通过调控健侧M1以增强患侧M1的β振荡,可能是一种改善卒中后功能恢复的潜在策略。
声明
此内容由英智科技临床支持部整理,欢迎批评指正。转载请注明出处。
参考文献
Jia, W., Zhou, Y., Mao, J., Feng, J., Han, Y., Xu, F., Wang, X., Liu, T., & Li, Z. (2025). Inhibition of Ipsilesional M1 β Oscillations by Contralesional M1 Following Acute Ischemic Stroke: A TMS-EEG Study. Stroke, 10.1161/STROKEAHA.124.050376. Advance online publication. https://doi.org/10.1161/STROKEAHA.124.050376